血管外科研究团队参与的一项新型促血栓物质研究成果在Cell Metabolism发表
近日,中山大学附属第一医院血管外科研究团队与中山大学孙逸仙纪念医院、广州医科大学附属市八医院、广州海关技术中心、深圳技术大学、国家超级计算广州中心等多个研究团队合作,在国际著名学术期刊Cell Metabolism(IF:29)上发表了题为Gut microbial co-metabolite 2-methylbutyrylcarnitine exacerbates thrombosis via binding to and activating integrin α2β1的重要研究成果,首次发现并证明了肠道菌群衍生的代谢产物二甲基丁酰基肉碱(2-methylbutyrylcarnitine, 2MBC)是一种新型的促血栓物质,并阐明其促进血栓性血管病变的发病机制,为该类疾病的防治提供了新的治疗靶点与思路。

血栓所引发的缺血性心血管事件如外周及内脏动脉栓塞/血栓形成、急性心肌梗塞、缺血性脑中风等,是导致全球成人致残和致死的首要病因。尤其是在肥胖、糖尿病、高脂血症等代谢功能紊乱状态下,血栓发生的风险较正常人群显著升高。目前认为,血小板高反应性是导致血栓风险升高的关键病理因素。尽管阿司匹林等抗血小板药物的使用可通过阻断血小板活化的下游通路,在一定程度上降低血栓事件发生的风险,但是伴之而来的则是大出血等不良事件的增加。此外,仍有大量肥胖、糖尿病等代谢紊乱患者存在阿司匹林抵抗,这也是导致血栓再发甚至是不良心血管事件发生的重要原因。迄今为止,诱发血小板反应性增高的上游调控机制仍不清楚。
研究团队通过代谢组学研究发现,酰基肉碱家族成员2MBC在急性冠脉综合征、缺血性脑中风及新冠感染患者血浆中明显升高,与血栓风险的升高有关。利用多种体内血栓动物模型及血小板功能实验,研究团队证实了2MBC可通过增高血小板反应性,促进血栓形成。机制上,2MBC激活p38/cPLA2通路,促进TXA2的产生,从而增高血小板的反应性。
蛋白分子磷酸化在调控血小板反应性中发挥重要的作用。为了探讨2MBC介导血小板反应性增高的分子机制,研究团队利用磷酸化蛋白组学进行检测分析,发现整合素蛋白通路可能在这一过程中发挥重要的调控作用。经过进一步筛选和验证,研究团队最终鉴定出整合素家族蛋白integrin α2β1是介导2MBC促血小板高反应性的关键受体。通过基因敲除或化合物靶向抑制integrin α2β1能够阻断2MBC介导的促血小板高反应性及促血栓作用。
通过禁食/恢复摄食、体外粪菌发酵、清除肠道细菌和粪菌移植等方法,研究团队进一步阐明了2MBC是一种肠道菌群衍生的代谢产物,可由二甲基丁酸在肠道细菌的作用下代谢产生;而利用抗生素鸡尾酒清除肠道细菌则可有效抑制2MBC在体内的转化,从而抑制其所介导的促血栓作用,提示2MBC可能是衔接肠道菌群紊乱与高血栓风险的重要中间介质。
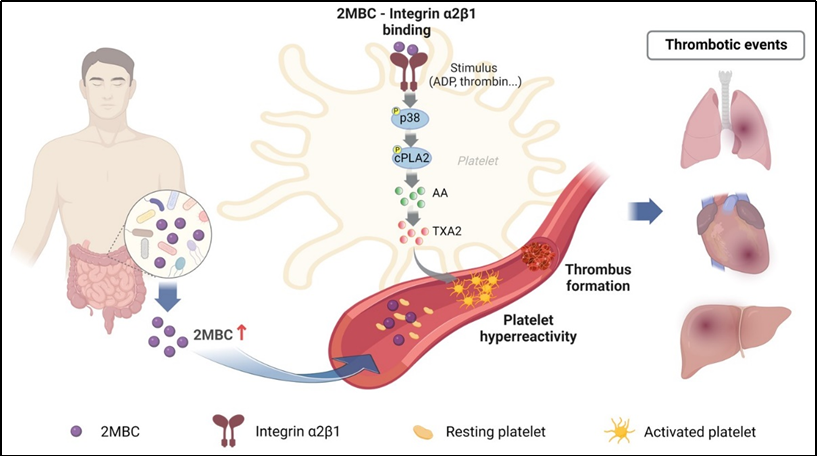
该研究首次报道了肠道菌群衍生的代谢产物2MBC作为一种新型的体内促血栓小分子化合物,可作为信号分子直接结合并激活细胞受体传递细胞内信号,从而发挥对细胞的功能调控作用。上述发现提示2MBC可能是血栓所诱发的缺血性心血管事件的潜在治疗新靶点,为该病的防治提供新的策略和思路。
中山一院血管外科黄侃博士后和李梓伦主任医师、广州医科大学附属市八医院何溪主任医师、广州海关技术中心戴俊教授、深圳技术大学黄炳顶教授、广州海关技术中心师永霞教授为该研究的共同第一作者。中山大学孙逸仙纪念医院陈思凡教授系该研究最后通讯作者,广州医科大学附属市八医院李凌华教授和中山大学孙逸仙纪念医院任萌教授为共同通讯作者。该研究受到中山大学孙逸仙纪念医院严励教授、广州市妇女儿童医疗中心李芳教授、中山大学计算机学院(国家超级计算广州中心)卢宇彤教授以及中山一院血管外科常光其教授等专家的大力支持和指导。
近年来,中山一院血管外科依托血管疾病诊治技术国家地方联合工程实验室,围绕代谢紊乱相关血管疾病展开系列研究,成果发表在Cell Metabolism、Signal Transduct Target Ther、J Am Heart Assoc等国际著名学术期刊,体现了中山一院在血管疾病研究领域的学术影响力。
原文链接:https://www.cell.com/cell-metabolism/abstract/S1550-4131(24)00014-7
(来源:血管外科)





